于开源在PNAS发表文章
于开源在PNAS发表文章
黏膜组织是微生物和人体最重要的相互作用界面。肠道黏膜组织聚集了人体70%以上的微生物群和免疫细胞。越来越多的证据表明微生物及其相关代谢物对于调节肠道免疫稳态具有极为重要的作用,影响稳态的微生物和效应物质的鉴定与机制解析是国际上的前沿研究领域。
炎症性肠病(IBD)是一类与免疫稳态失调密切相关的肠道炎性疾病,在我国发病率呈上升趋势。IBD 发病机制复杂,与环境、宿主遗传易感性、肠道菌群紊乱,免疫应答异常等多种因素有关。IBD的治疗长期以来是临床上面临的巨大挑战。调节肠道免疫稳态的共生菌群及代谢物质的研究有望为IBD治疗提供新思路。
该研究在人源肠道菌群中筛选获得一株兼性厌氧细菌-大肠杆菌Ec-TMU,发现该菌株能够产生丰富的色氨酸代谢物,其中吲哚-3-乳酸(ILA)具有显著的调节肠道稳态效应。机制方面,发现ILA 通过 AHR 下调糖酵解、NF-κB和 HIF 信号通路,抑制炎症环境中的上皮细胞产生CCL2/7,减少炎型巨噬细胞在结肠组织的累积。临床数据显示,粪便ILA 水平与IBD 进展显著负相关。该研究提出了肠道共生细菌调节肠道免疫稳态的新机制,为 IBD的治疗提供了潜在策略。
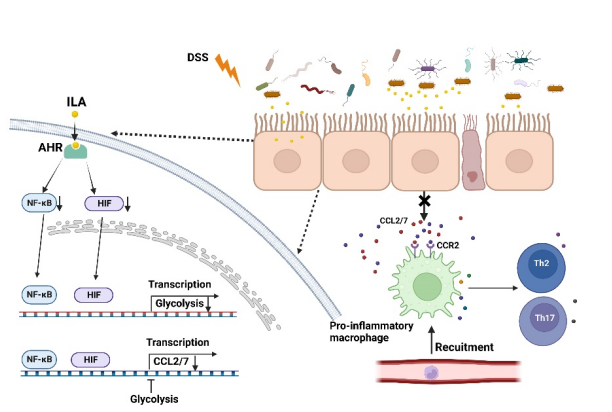
图1:ILA调节肠道稳态的作用机制示意图
此外,课题组前期在小鼠肠道菌群中筛选鉴定了一株具有缓解结肠炎的兼性厌氧细菌Enterobacter ludwigii,发现其通过代谢物诱导DC-Treg介导的免疫耐受调节肠道稳态。该研究2022年发表在《Cell Reports》,题为“Enterobacter ludwigii protects DSS-induced colitis through choline-mediated immune tolerance”。
目前很多研究认为兼性厌氧细菌是肠道稳态失调的原因,而忽略了这种现象可能更多是肠道微环境变化对菌群影响的结果。上述研究突破了对于兼性厌氧菌的固有认知,提示兼性厌氧细菌中存在多种菌株通过不同方式参与了肠道从炎症状态到免疫稳态恢复的过程,为肠道共生菌群和机体免疫系统互作的研究提供了新的角度。